Herpèsvirus équin 1 (EHV-1) et virus influenza équin (VIE)
Pourquoi étudier ces virus ?
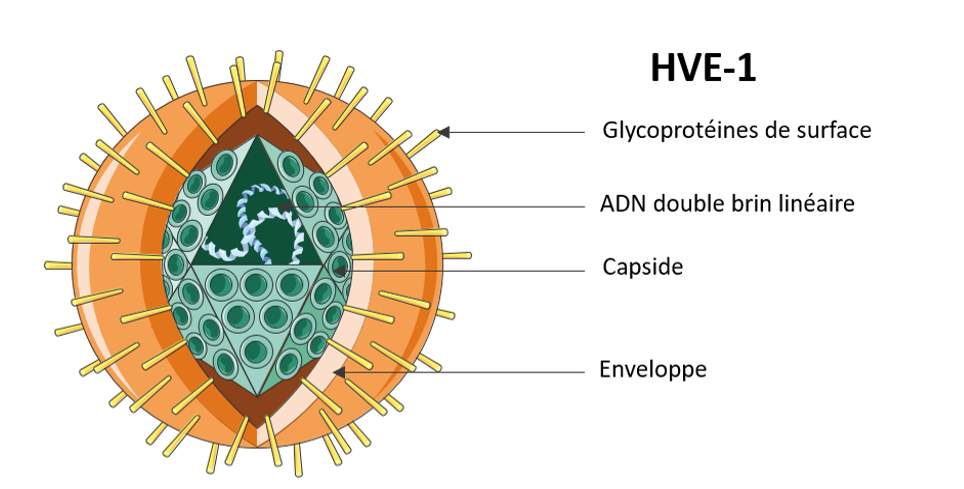
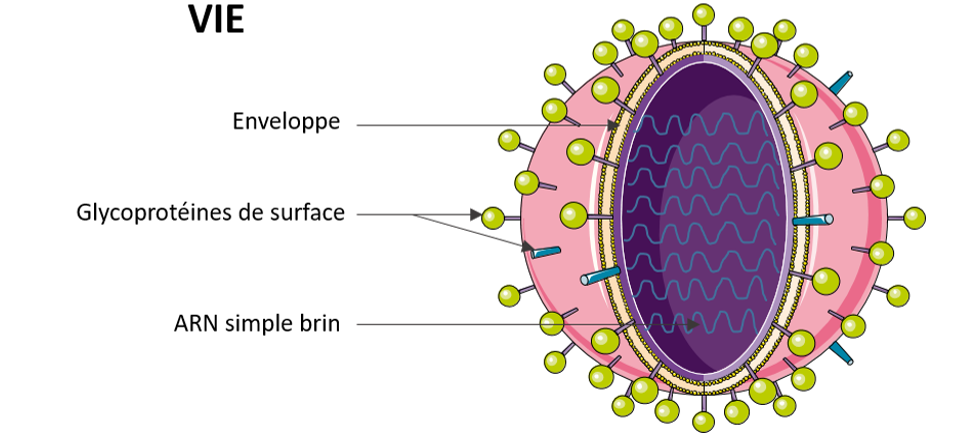
L’herpèsvirus équin-1 (HVE-1) et le virus influenza équin (VIE) sont fréquemment décrits dans de nombreuses parties du globe et sont deux pathogènes endémiques au sein de la population équine française. Ils sont responsables de troubles respiratoires caractérisés par l’apparition de fièvre, toux et écoulement nasal.
L’HVE-1 est également responsable de 2 formes graves de la maladie : une forme abortive et une forme nerveuse allant du trouble de la locomotion à la paralysie dans les cas les plus graves. Fortement contagieux, ils se transmettent d’un animal à l’autre principalement par les aérosols. Ces maladies infectieuses ont d’importantes conséquences aussi bien au niveau santé et bien-être animal qu’en terme d’impact économique.
La lutte contre ces virus repose essentiellement sur la mise en place de mesures préventives telles que la vaccination. Malgré cela, les épizooties d’HVE-1 et de VIE sont régulièrement observées en France et en Europe (crise VIE : Décembre 2018 ; crise HVE-1 : Mars 2021). Les vaccins contre la grippe équine ont une efficacité démontrée sur le terrain, en partie liée à la bonne couverture vaccinale. Les anticorps neutralisants, synthétisés en réponse à l’infection ou après immunisation, représentent la principale ligne de défense. Les vaccins utilisés pour prévenir les infections à HVE-1 sont généralement efficaces contre la forme respiratoire (rhinopneumonie) mais aucune preuve n’a été apportée à ce jour de leur efficacité contre la forme nerveuse. La limite de ce vaccin trouve son origine dans le type de réponse induite par le vaccin.
Mécanismes d’action et activité d’adjuvants vaccinaux innovants : modèle équin comme preuve de concept
Afin d’améliorer l’efficacité et la durée de réponse des vaccins, l’utilisation d’adjuvants (molécules présentes dans les vaccins et permettant d’augmenter leur efficacité) constitue une des voies de recherche pour améliorer l’immunogénicité, l’efficacité et la durée des réponses immunitaires que procurent ces vaccins.

Flora CARNET a effectué ses travaux de recherche au sein de l’unité BIOTARGEN de l’Université de Caen Normandie, hébergée dans les locaux de Normandie Équine Vallée à Saint-Contest.
Commencé en octobre 2019, l’objectif de ce projet de thèse était d’évaluer l’effet de molécules adjuvantes innovantes in vitro mais également in vivo chez le cheval.
- Une première étape du travail a consisté à caractériser les réponses induites par ces molécules sur des cellules immunitaires équines in vitro.
- Parallèlement, les étapes d’infection des cellules immunitaires par l’HVE-1 ont été étudiées afin d’apporter une meilleure compréhension de ces mécanismes pour mieux les contrer.
- Enfin, une étude in vivo a été réalisée dans les modèles vaccin rhinopneumonie (HVE1-4) et VIE afin d’apprécier les effets des molécules adjuvantes au cours de la vaccination.
Un nouveau modèle d’étude des mécanismes d’action du virus a été établi, grâce à une technique innovante basée sur la mesure d’impédance (RTCA ; Real-Time Cell Analysis).
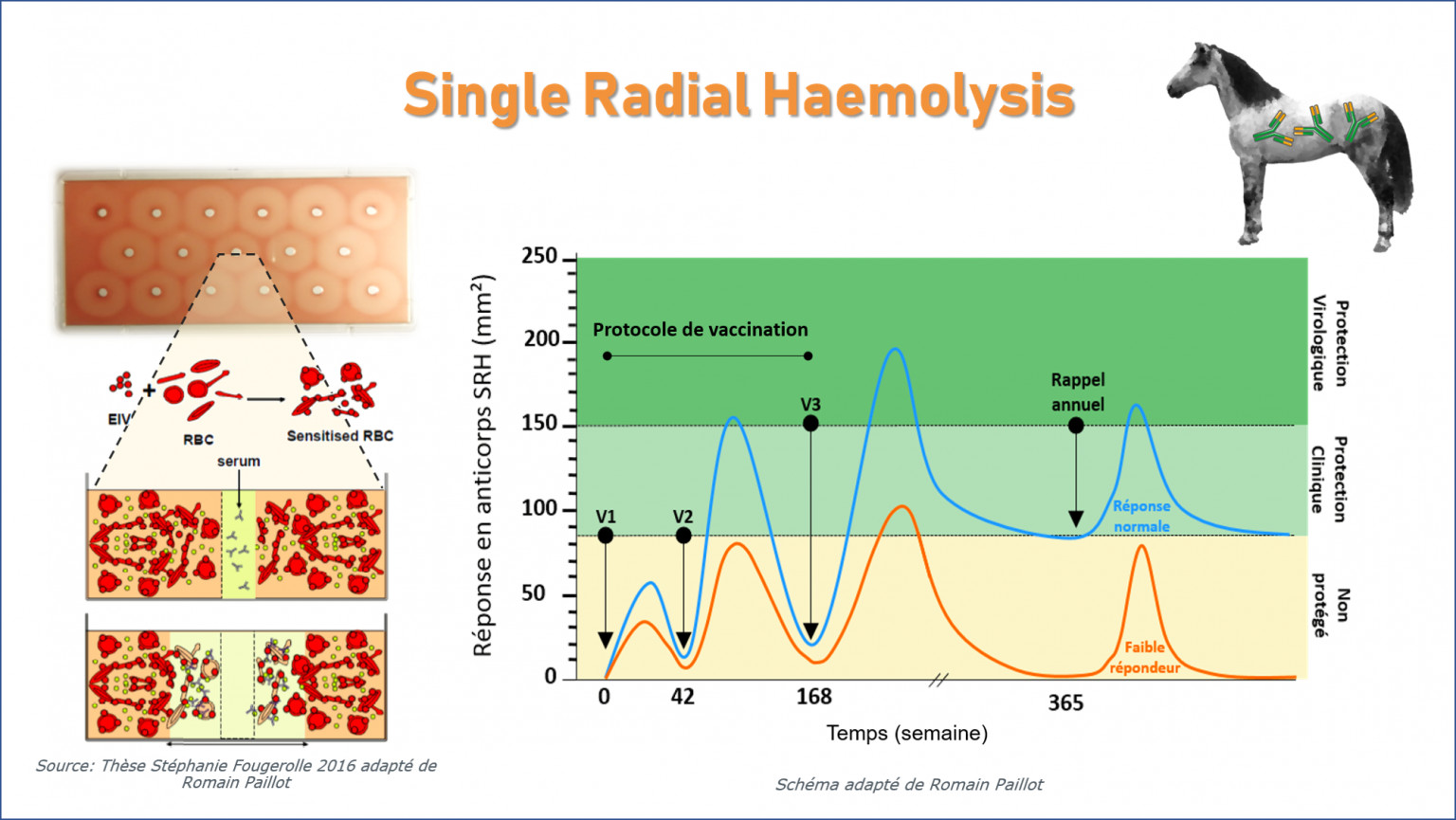
Méthode Hémolyse Radiale Simple (SRH) permettant de mesurer le titre en anticorps contre l’EIV dans un contexte d’infection et/ou de vaccination
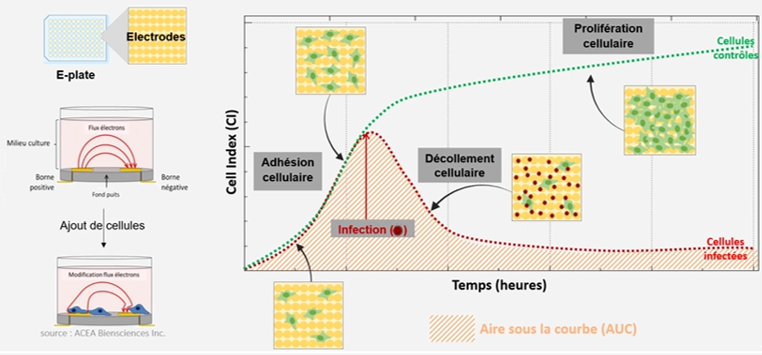
Principe de l’Impédancemétrie et de l’appareil xCELLigence®
Les travaux de recherche menés par Flora CARNET ont permis de démontrer que :
- L’iPPVO joue un rôle crucial dans la stimulation de la réponse Interféron (IFN) et notamment dans les réponses IFN de type 1 et 3 ;
- Les injections d’iPPVO pendant la vaccination contre la grippe équine permettent d’améliorer le niveau de protection des chevaux en augmentant le niveau d’anticorps mesuré par SRH ;
- L’impédancemétrie permet de mesurer la neutralisation de l’EIV par les sérums équins in vitro, et que les valeurs des titres mesurés par impédancemétrie sont corrélées avec les valeurs obtenues par SRH et les seuils de protection associés ;
- L’iPPVO permet de renforcer le pouvoir immunogène d’un vaccin EHV-1/4 inactivé contenant des carbomères en tant qu’adjuvant en augmentant la réponse immunitaire humorale de façon significative par rapport au groupe contrôle non traité.
